用語説明「超臨界流体」
「超臨界流体」は、超臨界状態の流体です。ここで流体とは、固体ではないという意味です。そして、流体が水の場合は超臨界水、二酸化炭素の場合は「超臨界二酸化炭素」あるいは「超臨界CO2」といいます。以下に超臨界の状態とは何かを記載しますが、まずその前に、固体、液体、気体について簡単に説明いたします。
固体、液体、気体とは?
物質には、固体、液体、気体の状態があります。例えば水の場合は「氷、液体の水、水蒸気」、二酸化炭素の場合は「ドライアイス、液化二酸化炭素、炭酸ガス」となります。固体、液体、気体は何が違うのでしょうか?

固体
分子が規則正しく並んでいる状態です。分子は振動していますが、それでも分子同士はしっかりと結合し、配置は基本的に変わりません。ですから、固体は形を持っています。
液体
分子同士が密に存在する点は固体と同じですが、分子同士の結合は常に入れ替わっているので、決まった位置に存在することはありません。このため液体は固体のように重くても、常にその形を変えることができます。
気体
分子同士が束縛されず、自由に飛び回っていて、その密度も希薄です。
温度が上昇して、分子同士の結合を振り切るほど運動エネルギーが高くなると、固体→液体→気体の変化が起こります 。また、分子同士の引力は、分子間の距離が近づくとある距離までは強くなっていきますので、圧力が高いほど気体は液体になりやすくなります(ちなみに、圧力が非常に低くなると、液体を経ずに固体から直接昇華して気体になります。常圧下でドライアイスが炭酸ガスに昇華する現象がこれに当たります)。
固体、液体、気体など、熱力学的に安定的な状態は、「相」と呼ばれています。
「相」は温度と圧力によりどうなるか?
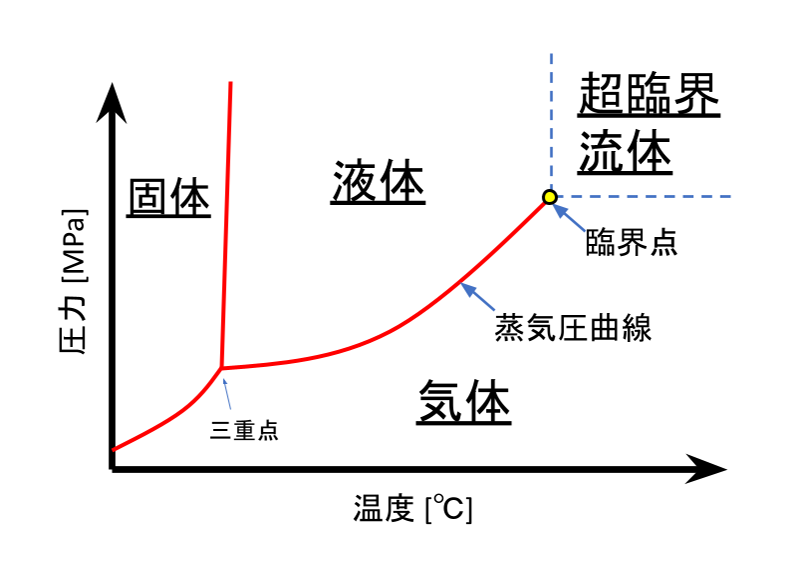
温度と圧力に関する「相図」は、各温度と圧力での熱力学的な相と、これらの相の境界がどこにあるかを表しています。相図は一般的に左図のようになります。ここで、液体と気体の境界線は「蒸気圧曲線」です。蒸気圧曲線よりも高温もしくは低圧で気体となります。蒸気圧曲線は、分子が密な液体と、分子がまばらで自由に飛び回っている気体の境界ですから、この曲線を挟んだ両側の状態は全く異なります。
この蒸気圧曲線は、「臨界点」で途切れます。臨界点の温度を臨界温度、臨界点の圧力を臨界圧力と呼びます。
そして、圧力が臨界圧力以上、かつ温度が臨界温度以上の場合、「超臨界流体」と呼びます。すなわち、図の青い点線より右上の領域です。
超臨界状態で蒸気圧曲線がなくなるという意味は、状態が不連続に変化する境界が存在しないことです。すなわち、超臨界流体と、液体または気体の境界は、青い点線ですが、このラインでの状態は滑らかに変化するだけです。例えば図中において、液体から超臨界状態を迂回して気体に変化させた場合、沸騰という現象なしに、いつの間にか気体になることになります。
この図の見方
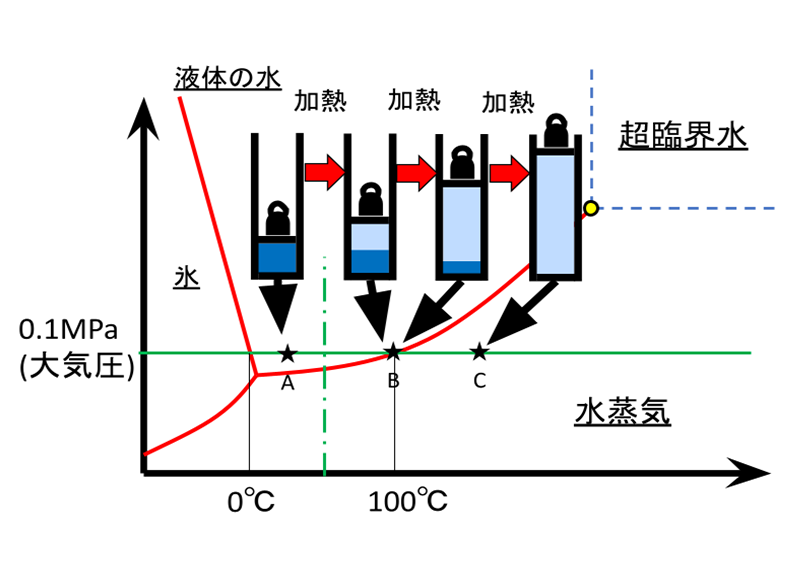
ここで再度、この図の見方について、具体例、すなわち大気圧の水を取り上げ、模式的に説明します。まず、水の入ったピストンに一定の大気圧(この図ではおもりで表現)をかけておきます。水はAの状態で全て液体です。これを加熱すると温度が上がり、蒸気圧曲線上のBに到達します。さらに加熱すると、液体の水が水蒸気に変わっていきますが、気化熱として熱が消費されますので、温度は100℃のまま上がりません。これが我々の目にする沸騰です。さらに加熱し、全ての水が水蒸気に変わった時点で100℃を超えて再び温度が上がり始めます。図では概念的に示しましたが、この時体積が1700倍に膨張し、密度は1/1700となります。同じことは、温度一定で圧力を変化させた場合(垂直の一点鎖線上の変化)にも当てはまります。
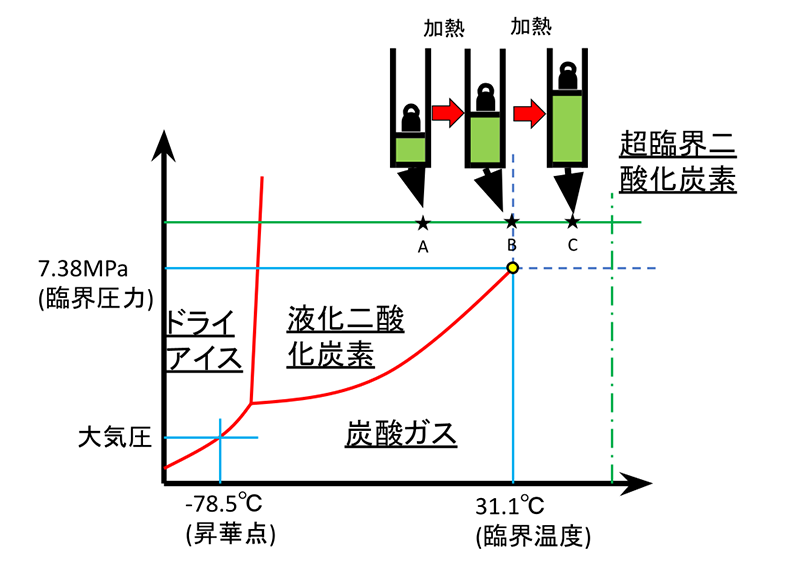
次に、臨界圧力以上での加熱を考えます。今度は二酸化炭素を例にとります。この場合、一度も蒸気圧曲線を通過しませんので、状態Bで足踏みすることなく温度は滑らかに上昇し、膨張していきます。もちろん、気体と液体のように相分離はしません。
同様のことは、臨界温度以上で圧力を変化させた場合(垂直の一点鎖線上の変化)にも当てはまります。
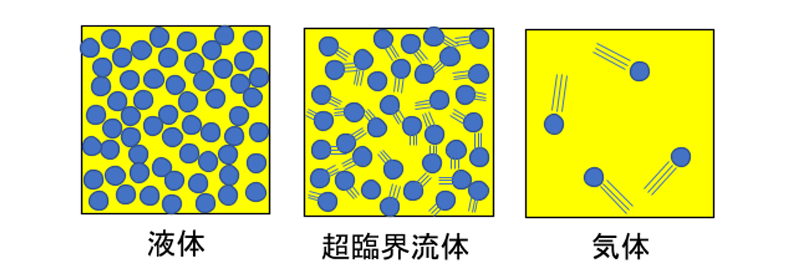
以上のことから、超臨界流体とは、密度が高い液体のようであっても、気体のように分子が激しく動き回るとともに、分子同士の結合が液体よりも弱い状態といえます。そして、我々の普段目にする低温低圧の状態の場合、液体と気体の中間的な流体は熱力学的に存在できないのに対し、高温高圧下では、液体と気体の区別がなく、目的にあった中間状態の流体を、温度と圧力を調整することで自由に形成させることができます。
ちなみに、液体であっても、超臨界流体に近い条件は亜臨界流体と言います。亜臨界状態の上限温度は臨界温度です。下限には明確な学術的定義がありません。水(亜臨界水)の場合、慣習的には、目的とする化学反応が、常圧下の熱水では事実上不可能であり、より高温(ただし超臨界水でない) で可能となれば、「亜臨界水」と呼ぶことが多いようです。
各物質の臨界点
超臨界状態になるのは、水や二酸化炭素だけでなく、他の物質にも当てはまります。以下に、臨界圧力と臨界温度の表を示します。これによると、二酸化炭素ボンベ内は夏場に超臨界状態となり、水素や窒素ボンベは常温で超臨界状態にあることが分かります。
| 臨界温度 [℃] | 臨界圧力 [MPa] | |
| 水 | 374.1 | 22.1 |
| 二酸化炭素 | 31.1 | 7.4 |
| エタノール | 243.1 | 6.4 |
| アンモニア | 132.4 | 11.3 |
| 水素 | -239.9 | 1.3 |
| 窒素 | -147.1 | 3.4 |
| 水銀 | >1400 | >170 |
超臨界水、超臨界CO2
各々の詳細については、当サイト内のリンクを参照してください。
超臨界CO2は、主に溶解度の変化を利用し、抽出、洗浄、乾燥、染色、鍍金、粒子製造などの用途があります。
超臨界水は、乾式では得られない反応場を提供します。反応を効率よく進めるため、各種合成や表面処理、化学物質の分解などの用途があります。
